PH E INDICADORES
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones
En este trabajo, se explicara de maneara clara y concisa temas relacionados estrechamente con el PH, sus indicadores, ademas de la neutralización. Temas que le serán de gran importancia a las estudiantes para el transcurso de su vida escolar.
OBJETIVOS
- Explicar claramente el concepto de cada una de los temas tratados en este blog
- Aclarar las dudas relacionadas que tengan las estudiantes sobre este tema
SECUNDARIAS:
- Ayudar a las estudiantes en su aprendizaje para que mas adelante utilicen en su vida académica estos conceptos
- Garantizar un aprendizaje significativo para cada estudiante
Neutralización
Se llama neutralización a la reacción que se produce entre disoluciones ácidas y básicas. Todas estas reacciones dan como producto una sal y agua. La reacción entre un ácido y una base se llama neutralización. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Si una de las especies es de naturaleza débil y la neutralización se produce en disolución acuosa también se obtiene su respectiva especie conjugada y agua. Se puede decir que la neutralización es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
La ecuación general que representa este tipo de reacción es:
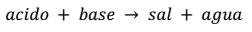
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
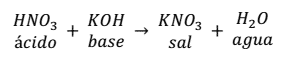
Como se puede observar en la reacción, la sal se forma entre el anión (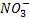 ) del ácido y el catión (K+).
) del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido sulfúrico y el hidróxido de sodio.
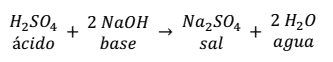
Como se puede observar en la reacción, la sal se forma entre el anión (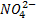 ) del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
) del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre ácidos fuertes y bases fuertes, es siempre la misma.
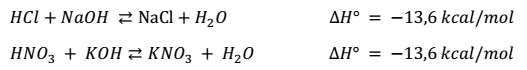
YENKA
HIDRÓXIDO DE POTASIO CON ÁCIDO NÍTRICO
HIDRÓXIDO DE POTASIO CON ÁCIDO SULFÚRICO
HIDRÓXIDO DE SODIO CON ÁCIDO CLORHÍDRICO
HIDRÓXIDO DE SODIO CON ÁCIDO DE NÍTRICO
PH E INDICADORES
pH
El pH es una unidad de medida que sirve para establecer el nivel de acidez o alcalinidad de una sustancia.
Se expresa como el logaritmo negativo de base de 10 en la actividad de iones de hidrógeno. Su fórmula se escribe de la siguiente manera:
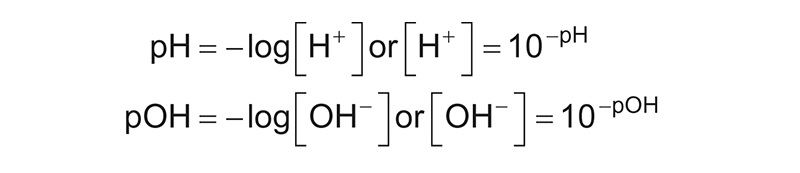
¿Qué significa el nivel de ácido en el pH?
Cuando se obtiene mediante una medida de pH que un producto, sustancia o elemento es ácido, quiere decir que posee una alta o baja cantidad de iones de hidrógeno (dependiendo del nivel).
Por su parte, que la medición arroje que una sustancia es alcalina (base), significa que no cuenta con estas concentraciones de iones de hidrógeno. Por lo tanto el pH no es más que el indicador del potencial de hidrógenos.
La escala de medida del pH
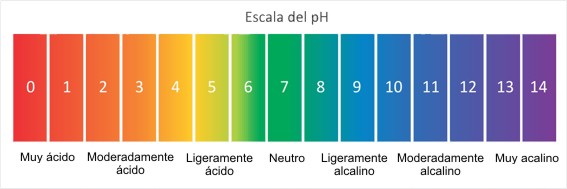
Así como para establecer los metros de una tabla, se usa una cinta de medir que posee milímetros, centímetros y metros, igualmente el pH cuenta con su propia escala. De esta forma encontraremos que ésta va desde 0 a 14.
Alcanzar el 0 (cero) es indicador de máxima acidez, por su parte, 14 es el opuesto, base. El punto intermedio es el 7, como su nombre indica, es lo neutral.
Ejemplos de ácidos
- Ácidos de baterias: Se encuentran entre el 0 y el 1, su nivel de ácido es tan fuerte que es perjudicial para las especies.
- Lluvia ácida: Es un fenómeno que se produce por la acumulación de ácidos provenientes de fósiles y combustibles. En la escala de ácidos se puede ubicar entre el 5 o 2 aproximadamente, siendo el primero el que cause menor daño (por ejemplo, afectar la reproducción de peces). Ya que alcanzar el 2, puede generar la muerte de especies acuáticas. De la misma forma la flora y fauna más delicada.
- Jugo de limón: Se ubica entre el 2 y el 3.
- Café: Se ubica en el 5.
Ejemplos de neutro
- Sangre
- Leche
Ejemplos de bases
- Leche de magnesia: En la tabla de pH se ubica entre 10 y 11. Este producto es de consumo medicinal.
- Lejía o cloro: Nivel de alcalinidad 13, se usa para la limpieza del hogar, baños, cocina y tiene el poder de decolorar la ropa.
¿Cómo se mide el pH?
Existe en el mercado un instrumento de fácil uso que se llama Papel de Tornasol. Se llama así debido a que cambia su color dependiendo de la solución en la que se sumerja, de esta forma los ácidos harán que el papel se vuelva rosa. De la misma manera, cuando se introduzca en una solución básica, se pondrá azul. Este papel se debe dejar unos segundos en contacto con lo que se quiere medir.
Para obtener un resultado más específico en la tabla usando estos mismos papeles de tornasol, existen con niveles, así que se debe seleccionar de forma aproximada el papel con la escala que le corresponde al producto que se medirá. De no conocerlo, tendrá que ser mediante ensayo y error.
Ahora bien, usar este tipo de medidor de pH tiene dificultades y puede no funcionar con todas las sustancias. Así que para uso profesional, se recomienda un voltímetro especifico, más conocido como pHmetro, que se usa además, con dos electrodos. Estos últimos generan corriente para hacer más evidente la presencia de iones de hidrógeno, algo que se verá reflejado en el pHmetro.
¿Qué son las soluciones búfer?
Son utilizadas para mantener el nivel de acidez o de alcalinidad de una sustancia expuesta a reacciones químicas, esto evita que se generen reacciones indeseadas.
INDICADORES DE PH
Un indicador de pH es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador a sustancias químicas que cambian su color al cambiar el pH de la disolución. El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie. Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1-4,4, de color rojo a naranja, y la fenolftaleína, que varía desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados/violetas. Además se pueden usar indicadores caseros como la disolución resultante de hervir con agua col lombarda (repollo colorado), pétalos de rosa roja, raíces de cúrcuma a partir de las cuales se obtiene curcumina, y otros(entre los cuales podemos destacar a la col morada y la piel de ciruela, que son usadas por algunas culturas indígenas).
Los indicadores de pH tienen una constante de protonación,  , que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.
, que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.
 , que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.
, que informa sobre el desplazamiento de la reacción de protonación de la forma básica del indicador.![{\displaystyle K={\frac {[H^{+}][I^{-}]}{[HI]}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3aa0827ba8285cf67422e1984fa819ca320a1402)
El cambio de color de un indicador es apreciable cuando la concentración de la forma ácida o de la forma básica es superior o igual a 10 veces la concentración de la forma básica o la forma ácida respectivamente.
Los indicadores son colorantes orgánicos, que experimentan una variación de color que se puede observar en una escala numérica llamada escala pH. Según estén en presencia de una sustancia ácida o básica el color es de un tono determinado.
Este indicador está dividido en ácidos y bases y en la parte central donde se encuentran estas dos substancias, se encuentra otro tipo de carácter llamado neutro, en el que la substancia está equilibrada. Es decir, tiene tanto carácter básico como ácido.

Nos indica el carácter de una determinada substáncia.

FENOLTALEINA:
La fenolftaleína de fórmula (C20H14O4) es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en presencia de disoluciones básicas toma un color rosado con un punto de viraje entre pH=8,0 (incoloro) a pH=9,8 (magenta o rosado). Sin embargo en pH extremos (muy ácidos o básicos) presenta otros virajes de coloración; en la cual la fenolftaleína en disoluciones fuertemente básicas se torna incolora, mientras que en disoluciones fuertemente ácidas se torna naranja.
Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico.
La fenolftaleína normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa. El cambio de color no puede explicarse solo basándose en la desprotonación, se produce un cambio estructural con la aparición de una tautomería cetoenólica.

TORNASOL:
El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece solo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleína.
UNIVERSAL:
Existe un indicador universal que nos da el pH de acuerdo a una escala de colores. El color rosa corresponde al ácido más fuerte con un pH de cero a uno y el color azul a una base muy fuerte con valores de Ph entre 13 y 14. Los otros colores muestran el cambio de coloración del papel indicador cuando las sustancias tienen valores de pH de entre 2 y 13. Usando este papel indicador cualquier individuo puede identificar el pH de los alimentos y clasificarlos en ácidos, básicos y neutros dependiendo de la coloración. Si el color está entre el rosa y el amarillo, es decir, con un valor mayor a cero y menor a 7, los alimentos serán ácidos, pero si el papel indicador nos da una coloración entre verde amarillento y azul, los alimentos tendrán características de bases.
YENKA
PH E INDICADORES
TITULACIÓN
La valoración o titulación es un método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida. Debido a que las medidas de volumen desempeñan un papel fundamental en las titulaciones, se le conoce también como análisis volumétrico.
Un reactivo llamado “valorante” o “titulador” de volumen y concentración conocida (una solución estándar o solución patrón) se utiliza para que reaccione con una solución del analito, de concentración desconocida. Utilizando una bureta calibrada para añadir el valorante es posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final. El punto final es el punto en el que finaliza la valoración, y se determina mediante el uso de un indicador. Idealmente es el mismo volumen que en el punto de equivalencia—el número de moles de valorante añadido es igual al número de moles de analito, algún múltiplo del mismo (como en los ácidos polipróticos). En la valoración clásica ácido fuerte-base fuerte, el punto final de la valoración es el punto en el que el pH del reactante es exactamente 7, y a menudo la solución cambia en este momento de color de forma permanente debido a un indicador. Sin embargo, existen muchos tipos diferentes de valoraciones (ver más adelante). Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales (cambian de color). En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo en medio ácido y amarillo en disoluciones básicas. No todas las titulaciones requieren un indicador. En algunos casos, o bien los reactivos o los productos son fuertemente coloreados y pueden servir como "indicador". Por ejemplo, una titulación o valoración redox que utiliza permanganato de potasio como disolución estándar (rosa/violeta) no requiere indicador porque sufre un cambio de color fácil de detectar pues queda incolora al reducirse el permanganato. Después del punto de equivalencia, hay un exceso de la disolución titulante (permanganato) y persiste un color rosado débil que no desaparece.
Debido a la naturaleza logarítmica de la curva de pH, las transiciones en el punto final son muy rápidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de color del indicador y el punto de equivalencia de la titulación o valoración. Este error se denomina error del indicador. Por este motivo es aconsejable efectuar determinaciones en blanco con el indicador y restarle el resultado al volumen gastado en la valoración.
YENKA TITULACIÓN:
CONCLUSIONES
- El ph es el indicador de acidez o basicidad de una sustancia. Es muy importante en la química
- Existen algunos indicadores de este ph, que son comúnmente utilizados en química
- La valoración o titulación es un método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida.
WEBGRAFIA
- Obtener enlace
- X
- Correo electrónico
- Otras aplicaciones






PUDO CONSULTAR MAS MARCO TEÒRICO Y CADA PRÀCTICA ERA POR SEPARADO 4.0
ResponderEliminar