Reacciones quimicas
ECUACIONES QUÍMICAS
INTRODUCCIÓN
Por medio del presente trabajo se quiere dar a conocer detalladamente las diferentes clases de reacciones químicas por medio de la practica o la experimentación, para así poder establecer una relación entre los principios teóricos y los hechos experimentales, lo cual nos permitirá diferenciar los tipos de reacciones.
OBJETIVOS
Dar a conocer y que aprendan un poco mas de las reacciones y ecuaciones químicas y así poder mejor y enriquecer, también poder conocer cuales son los tipos o clases de estas y poder hacer un buen trabajo para todo aquel que lo lea
Poder tambien enriquecer mi conocimiento sobre este tema
REACCIÓN QUÍMICA
también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas refractantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos.Los refractantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total. Proceso en el que una o más sustancias los reactivos se transforman en otras sustancias diferentes los productos de la reacción. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
La importancia de dichas reacciones es notoria en muchos aspectos de la vida diaria en fenómenos tales como explosiones; procesos vitales tales como alimentación, respiración etc. Todas las sustancias que a diario utilizamos son o fueron producto de reacciones químicas.




CLASES DE REACCIONES
REACCIÓN DE COMPOSICIÓN O SÍNTESIS: En las reacciones de síntesis o composición es donde dos refractantes se combinan para formar un solo producto. Muchos elementos reaccionan con otro de esta manera para formar compuestos, por ejemplo:
2CaO(s) + 2H2O(l) ! 2Ca(OH)2(ac)
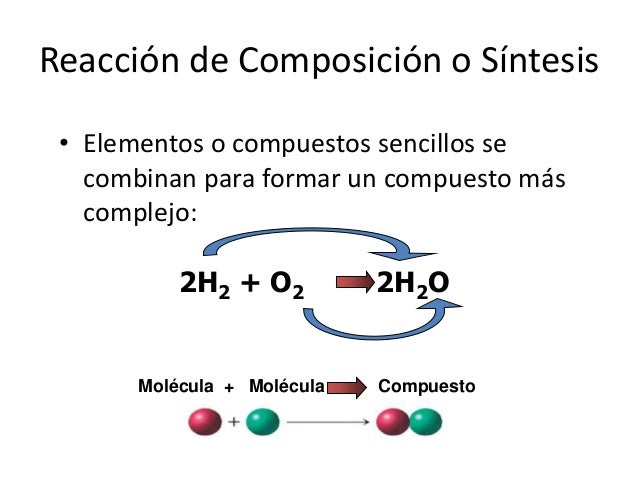
en esta formula se mezclan 2 moles de oxido de calcio sólido con 2 moles de agua liquida reacciona produciendo 2 moles de dihidroxido de calcio acuoso.
REACCION DE DESCOMPOSICION O ANÁLISIS: Este tipo de reacción es contraria a la de composición o síntesis ya que en esta no se unen 2 o mas moléculas para formar una sola, sino que una sola molécula se divide o se rompe para formar varias moléculas mas sencillas, por ejemplo:
2HgO (s) ! 2Hg(l) + O2(g)
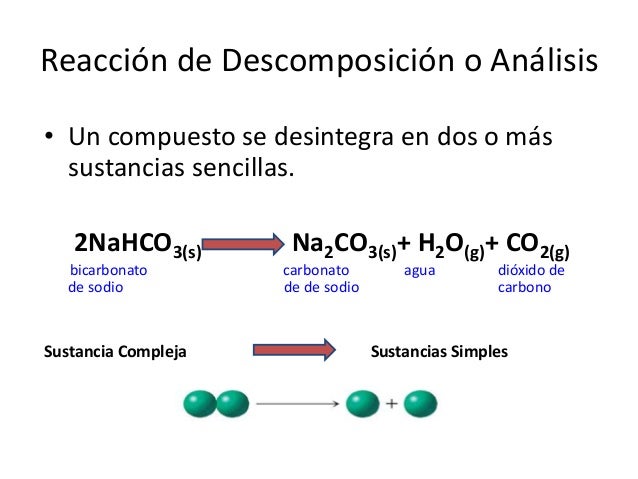
en esta formula una 2 molécula de oxido de mercurio sólido se descomponen o dividen para formar 2 moléculas de mercurio y una de oxigeno, las cuales son mas sencillas que la primera.
REACCION DE DESPLAZAMIENTO O SUSTITUCIÓN: En este tipo de reacción, un elemento libre sustituye y libera a otro elemento presente en un compuesto, su ecuación general es:
CuSO4 + Fe ! FeSO4 + Cu

En esta reacción un mol de sulfato de cobre con 1 mol de hierro para formar sulfato de hierro y cobre
REACCION DE DOBLE SUSTITUCIÓN O DOBLE DESPLAZAMIENTO: Son aquellas reacciones que se dan por intercambio de átomos entre los reactivos
AB + CD----------------- AC + BD
Por Ejemplo:
K2S + MgSO4 ! K2SO4 + MgS


En esta reacción 1 mol de sulfuro de potasio reaccionan con sulfato de magnesio para formar sulfato de potasio y sulfuro de magnesio.
ECUACIÓN QUÍMICA
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
En 1615 Jean Beguin publicó Tyrocinium Chymicum, uno de los primeros trabajos escritos sobre química, en donde redacta la primera ecuación química de la historia


REQUISITOS PARA UNA ECUACIÓN QUÍMICA
- Cumplir con la ley de conservación de la materia.
- Cumplir con la ley de conservación de la carga.
- Cumplir con la ley de conservación de la energía.
- Corresponder a un proceso real.
COMO SE ESCRIBE UNA ECUACIÓN
- Los reactivos se separan de los productos con una flecha que indica el sentido de la reacción. Una flecha doble indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
- Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
- Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula colocada sobre la flecha indica que se suministra calor a la reacción.
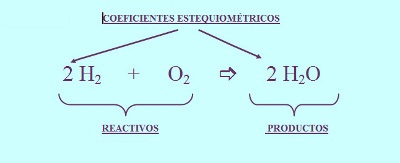
- Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
- El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
- Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
- Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
- Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique
EJEMPLOS
Formación de precipitados.
Formación de gases acompañados de cambios de temperatura. Desprendimiento de luz y de energía.
Reglas:
Ejemplo:
En toda reacción se conservan los átomos y las cargas (si hay iones)
No puede ocurrir un proceso de oxidación o de reducción aislado, ambos ocurren simultáneamente.
No se pueden formar productos que reaccionen enérgicamente con alguno de los productos obtenidos.
Na3N + 3H2O 3 NaOH + NH3

WEBGRAFIA
http://www.monografias.com/trabajos88/ecuaciones-y-reacciones-quimicas/ecuaciones-y-reacciones-quimicas.shtml
http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
https://laquimicablog09.wordpress.com/2014/11/17/caracteristicas-de-las-reacciones-y-ecuaciones-quimicas/
http://www.iered.org/archivos/Proyecto_coKREA/REAfinales2014/ReaccionesQuimicas_MagalyHenao/clases_de_reacciones_qumicas.html
https://es.wikipedia.org/wiki/Ecuaci%C3%B3n_qu%C3%ADmica
https://www.definicionabc.com/ciencia/reaccion-quimica.php
https://es.khanacademy.org/science/biology/chemistry--of-life/chemical-bonds-and-reactions/a/chemical-reactions-article


Comentarios
Publicar un comentario